主页 > 生活 >
方法 1解焓值问题

1
确定反应的生成物和反应物。任何化学反应都涉及两种化学物质,即生成物和反应物。生成物是反应“生成”的化学物质,而反应物是通过“相互作用、组合或分解”来生成生成物的化学物质。换而言之,化学反应的反应物就像食谱中的原料,而生成物就像做好的菜肴。要计算出反应的∆H,首先得确定反应的生成物和反应物。
- 例如,假设我们要计算氢气和氧气生成水的反应焓:2H2 (氢气) + O2 (氧气) → 2H2O (水)。方程式中,H2和O2是反应物,而H2O是生成物。

2
确定反应物的总质量。下一步需要计算反应物的质量。如果不知道它们的质量,也无法称量反应中的反应物,你可以使用它们的摩尔质量来算出它们的真实质量。查询标准的元素周期表或关于分子和化合物的其他化学资料,可以找到摩尔质量。只需用每种反应物的摩尔质量乘以消耗的反应物摩尔数,就能算出反应物的质量。
- 在水的例子中,反应物是氧气和氢气,它们的摩尔质量分别为2g和32g。由于方程式中H2旁边的系数为“2”,而O2旁边没有系数,所以反应中会用掉2摩尔的氢气和1摩尔的氧气,因此,反应物总质量的计算过程如下:2 × (2g) + 1 × (32g) = 4g + 32g = 36g。

3
找出生成物的比热。下一步需要找出你分析的生成物的比热。每种元素或分子都有一个与之相关的比热值:这些值是常数,通常可以在化学课本后的表格中或其他化学资料中查到。比热有几种不同的度量方式,本公式中,我们会使用以J/(g• °C)为单位的比热值。
- 注意,如果方程式有多种生成物,那么你必须对生成各生成物的组分反应进行焓计算,然后将它们加总,算出整个反应的焓。
- 本示例中,最终生成物是水,它的比热约为4.2 J/(g• °C)。

4
计算反应前后的温度差。下一步我们需要计算∆T,也就是反应前后的温度变化。用反应的初始温度T1减去反应的最终温度T2,来算出∆T。和大多数化学计算一样,此处应该使用开尔文(K)温度,但使用摄氏(C)温度也会得到同样的结果。
- 在本示例中,假设一开始的反应温度是185K,反应结束时的温度是95K。这种情况下,∆T的计算过程如下:∆T = T2 – T1 = 95K – 185K = -90K。

5
使用公式∆H = m x s x ∆T来求解。 知道反应物的质量m、生成物的比热s,以及反应的温度变化∆T后,你就能算出反应焓了。只需将它们的值代入到公式∆H = m x s x ∆T中,然后做乘法就可以了。答案的单位将是能量单位焦耳(J)。
- 在本例题中,反应焓的计算过程如下:∆H = (36g) × (4.2 JK-1 g-1) × (-90K ) = -13,608 J。

6
判断反应是失去能量还是获得能量。之所以要计算各种反应的∆H,大部分情况下是为了确定反应是放热的还是吸热的,前者会失去能量并释放热量,而后者会获得能量并吸收热量。如果∆H的最终答案是正数,那么反应就是吸热反应。反之,如果答案是负数,那么反应就是放热反应。数字越大,表示反应释放或吸收的热量越多。对强放热反应要多加小心,它们有时会释放出大量能量,要是释放的速度足够快,甚至可能引起爆炸。
- 本例题中,我们的最终答案是-13608 J,由于是负数,所以我们知道反应是放热反应。这是合理的,因为H2和O2是气体,而生成物H2O是液体。蒸汽形式的高温气体需要以热量的形式向环境释放能量,冷却到能够形成液体水的温度,这意味着形成H2O的过程是一个放热过程。
方法 2估算焓值

1
使用键能来估算焓值。几乎所有化学反应都会涉及到原子间键的形成或断裂。由于化学反应中的能量既不会凭空消失也不会凭空出现,所以,要是知道反应中形成键或破坏键所需的能量,我们就能将这些键能相加,非常准确地估算出整个反应的焓变。
- 让我们以反应H2 + F2 → 2HF为例。在该反应中,破坏H2分子中的H原子所需要的能量是436 kJ/mol,而F2所需要的能量是158 kJ/mol。最后,H和F形成HF所需的能量等于-568 kJ/mol。由于方程式中的生成物是2HF,所以我们需要乘以2,即2 × -568 = -1136 kJ/mol。将所有值相加求和,得到: 436 + 158 + -1136 = -542 kJ/mol。

2
使用生成焓来估算焓值。生成焓是固定的∆H值,它代表生成特定化学物质所用的反应焓变。如果知道生成方程式中的生成物和反应物所需的生成焓,你可以将它们相加,来估算焓值,其方法与上文所述的键能方法非常类似。
- 让我们以反应C2H5OH + 3O2 → 2CO2 + 3H2O为例。在该反应中,我们知道如下反应的生成焓:C2H5OH → 2C + 3H2 + 0.5O2 = 228 kJ/mol2C + 2O2 → 2CO2 = -394 × 2 = -788 kJ/mol 3H2 + 1.5 O2 → 3H2O = -286 × 3 = -858 kJ/mol 由于将这些方程式相加后可以得到C2H5OH + 3O2 → 2CO2 + 3H2O,正是我们想要计算焓值的方程式,所以我们只需将以上反应的生成焓相加,就能算出该反应的焓值,计算过程为: 228 + -788 + -858 = -1418 kJ/mol。

3
颠倒方程式时不要忘了改变符号。一定要注意,使用生成焓来计算反应的焓值时,只要颠倒了组分反应的方程式,就需要改变生成焓的符号。换而言之,如果为了得到所有生成物和反应物,以便将它们约去,你颠倒了一个或多个生成反应方程式,那么你必须改变这些生成反应方程式焓值的符号。
- 你应该注意到了,在之前的示例中,我们为C2H5OH而使用的生成反应是颠倒的。C2H5OH → 2C + 3H2 + 0.5O2展示的是C2H5OH的分解过程,而不是它的形成过程。由于为了得到所有生成物和反应物,以便将它们约去,我们颠倒了方程式,所以我们必须改变生成焓的符号,得到228 kJ/mol。实际上,C2H5OH的生成焓等于-228 kJ/mol。
方法 3实验观察焓变

1
找一个干净的容器,装满水。通过一个简单的实验,我们很容易看出焓的作用原理。为了确保实验反应发生时不受到任何外来污染物的影响,请清洁打算使用的容器,并进行消毒。科学家会使用一种被称为“量热计”的特殊密闭容器来测量焓值,但使用小玻璃杯和烧瓶来做实验,你也能得到合理的结果。无论使用什么容器,用干净的室温自来水装满容器。你应该在室内某个温度较低的地方来进行反应。
- 本实验需要一个非常小的容器。我们会测试泡腾片的焓变效应,所以用的水越少,温度的改变就越明显。
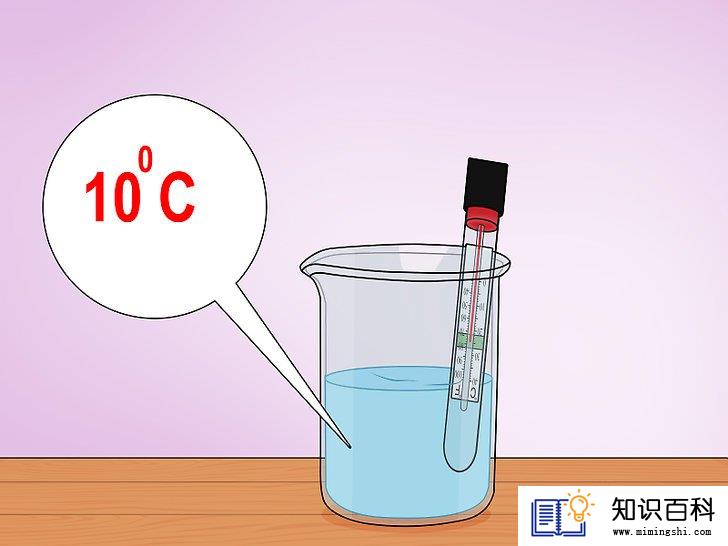
2
将温度计插入容器中。找一支温度计,把它插入容器,使玻璃泡位于水平面以下。读出水的温度,就本实验而言,水的温度就是反应的初始温度T1。
- 假设我们测量水的温度,发现刚好等于10摄氏度。稍后我们会用温度计样本读数来说明焓的原理。

3
将泡腾片放入容器中。做好开始实验的准备后,放一片泡腾片到水中。你会发现它立即开始鼓泡并发出嘶嘶声。随着泡腾片在水中溶解,它会分解成碳酸氢盐HCO3-和柠檬酸,柠檬酸会以氢离子H+的形式发生反应。这些化学物质会在3HCO3− + 3H+ → 3H2O + 3CO2反应中生成水和二氧化碳气体。

4
反应完成后测量温度。监控反应过程,泡腾片应该会逐渐溶解。泡腾片反应结束后,或反应速度边得很慢后,再次测量温度。水的温度应该比之前稍低一点。如果水温升高,那么实验可能受到了外部因素的影响,例如所在房间的温度过高。
- 本实验中,假设泡腾片起泡结束后水的温度是8摄氏度。

5
估算反应的焓值。在理想的实验中,将泡腾片加入水中时,它会生成水和气泡形式的二氧化碳气体,并导致水温下降。根据这些信息,我们就能预计反应是吸热反应,即从周围环境中吸收能量的反应。溶解的液态反应物需要额外的能量才能变成气态生成物,所以它会以热量的形式从周围的环境中吸收能量,在本反应中,周围的环境就是水。这会让水温下降。
- 本实验中,加入泡腾片后水温下降了两度。这与我们预计的温和吸热反应表现一致。
小提示
- 这些计算使用的是开尔文(K)温度,和摄氏度一样,开尔文是温度计量单位。要在摄氏度和开尔文之间转换,只需要加上或减去273度就可以了:K = °C + 273。
- 上一篇:如何计算化学中的产率
- 下一篇:如何计算半衰期
