主页 > 生活 >
方法 1使用克劳修斯-克拉珀龙方程

1
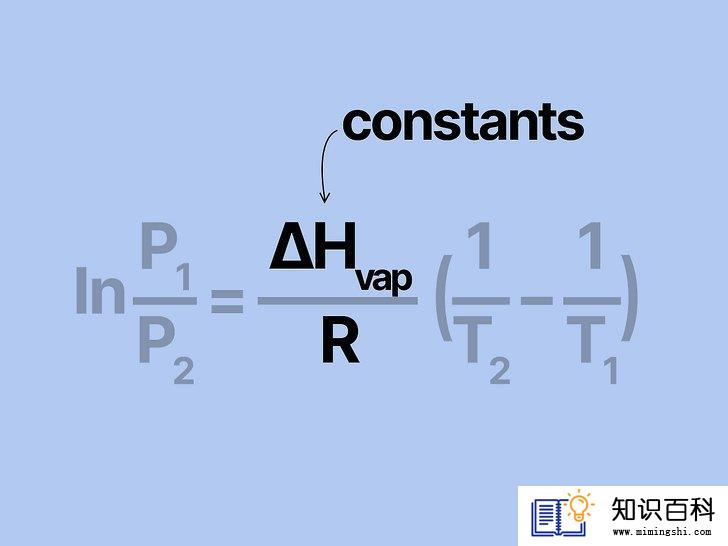
写出克劳修斯-克拉珀龙方程。根据蒸气压随时间的变化率来计算蒸气压的公式被称为克劳修斯-克拉珀龙方程,它以物理学家鲁道夫•克劳修斯和伯诺瓦•保罗•埃米尔•克拉珀龙的名字命名。解物理课和化学课上最常见的蒸汽问题,通常使用的就是这一公式。公式写作:ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1))。其中,各变量的含义如下:
- ΔHvap:液体的汽化焓。这个值通常可以在化学课本后的表格中查到。
- R:理想气体常数,即8.314 J/(K × Mol)。
- T1:蒸气压已知时的温度,或起始温度。
- T2:求蒸气压时的温度,或最终温度。
- P1和P2:温度为T1和T2时的蒸气压。
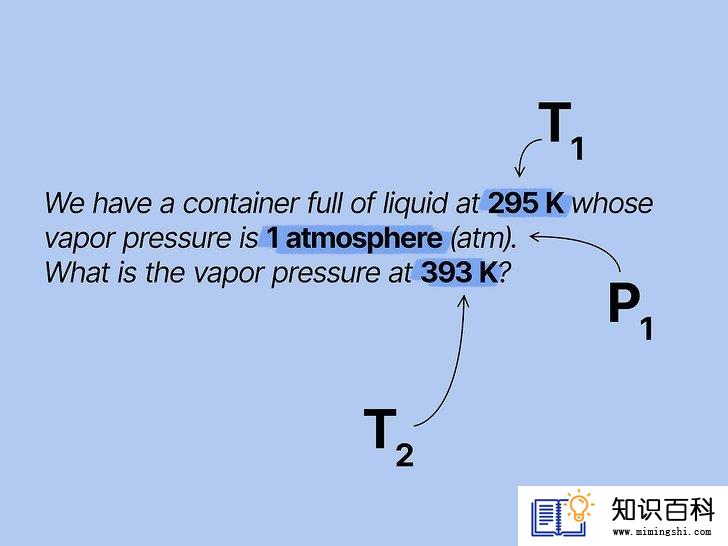
2
将已知值代入公式中。由于克劳修斯-克拉珀龙方程有很多不同的变量,所以看上去有些复杂,但掌握了正确的信息后,方程其实并不难。最基础的蒸气压问题会给出两个温度值和一个压力值,或给出两个压力值和一个温度值。有了这些已知条件后,解题就很简单了。
- 例如,假设题目告诉我们,温度为295 K时,装满液体的容器的蒸气压为1个标准大气压(atm)。题目问:“温度为393 K时,蒸气压等于多少?”我们已知两个温度值和一个压力值,所以可以使用克劳修斯-克拉珀龙方程来求出另一个压力值。将已知值代入变量中,得到ln(1/P2) = (ΔHvap/R)((1/393) - (1/295))。
- 注意,克劳修斯-克拉珀龙方程必须使用开尔文温度值。而压力值可以使用任意单位,只要P1和P2保持统一即可。
3
代入常数。克劳修斯-克拉珀龙方程包含两个常数:R和ΔHvap。R始终等于8.314 J(K × Mol)。而汽化焓ΔHvap的值则取决于你计算的是哪种物质的蒸气压。如上所述,你通常可以在化学课本或物理课本后面查到各类物质的ΔHvap 值,你也可以上网查询,例如查询本网站。
- 本例题中,假设液体是纯液态水。查询表格后,我们发现ΔHvap约等于40.65 kJ/mol。由于计算中使用的H值单位是焦耳,而不是千焦,所以我们需要将ΔHvap的值转换为40,650 J/mol。
- 将常数代入到方程中,得到 ln(1/P2) = (40,650/8.314)((1/393) - (1/295))。

4
解方程。将所有变量代入到方程中,如果只有待解的变量未知,那么你可以使用普通代数知识来解方程。
- 解方程ln(1/P2) = (40,650/8.314)((1/393) - (1/295))的唯一难点是它涉及到自然对数log (ln)。要消去自然对数,只需将方程两边用作数学常数e的指数即可。换而言之,ln(x) = 2 → eln(x) = e2 → x = e2。
- 现在,让我们来解方程:
- ln(1/P2) = (40,650/8.314)((1/393) - (1/295))
- ln(1/P2) = (4,889.34)(-0.00084)
- (1/P2) = e(-4.107)
- 1/P2 = 0.0165
- P2 = 0.0165-1 = 60.76 atm。答案是合理的,在密封容器中,温度上升了近100度,超出水的沸点近20度,导致产生大量液体,使压力大大增加。
方法 2计算溶液的蒸汽压

1
写出拉乌尔定律。现实生活中很少有单一的纯净液体,我们通常面对的是几种不同成分物质的混合液体。其中最常见的混合物是少量被称为溶质的化学物质,溶解在大量被称为溶剂的化学物质中,形成的溶液。这时,就需要用到被称为“拉乌尔定律”的方程了。该定律是以物理学家F•-M•拉乌尔的名字命名,写作:P溶液=P溶剂X溶剂。其中,各变量的含义如下:
- P溶液:包括所有组分的整个溶液的蒸气压
- P溶剂:溶剂的蒸气压
- X溶剂:溶剂的摩尔分数。
- 如果你不知道“摩尔分数”等术语的含义,不用担心,我们会在后续步骤中进行说明。

2
确定溶液中的溶剂和溶质。计算混合液体的蒸汽压之前,你需要先确定自己面对的是哪些物质。提醒一下,溶液是溶质在溶剂中溶解后形成的,因此溶解的化学物质一定是溶质,而溶解其他化学物质的一定是溶剂。
- 让我们通过本节中的一道简单例题,来说明这些概念。本示例中,假设我们要计算单糖浆的蒸气压。一般而言,单糖浆是一份糖溶于一份水形成的,所以我们会说糖是溶质,水是溶剂。
- 注意,蔗糖的化学式是C12H22O11。这是马上会用到的重要信息。
3
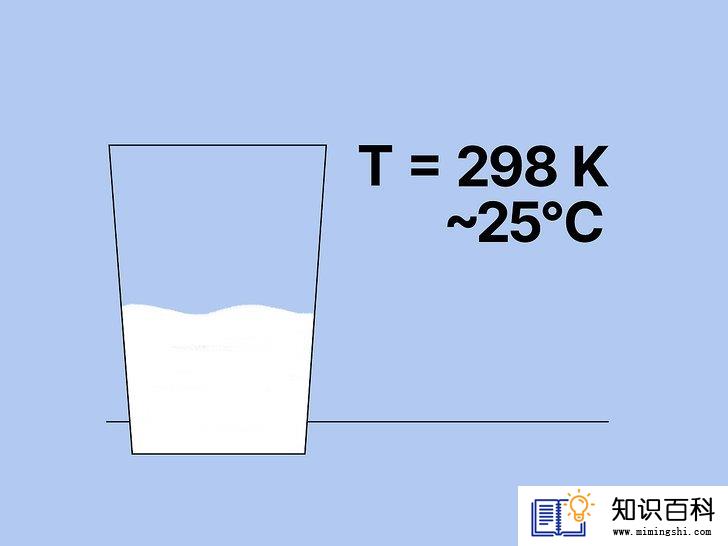
求得溶液温度。正如上文克劳修斯-克拉珀龙方程一节所述,液体的温度会影响它的蒸气压。通常情况下,温度越高,蒸气压越大,因为随着温度上升,更多的液体会蒸发并形成蒸汽,从而使容器内的压力上升。
- 本例题中,假设单糖浆当前的温度为298 K,即25摄氏度左右。

4
求得溶剂的蒸气压。化学参考资料通常会列出许多常见物质和化合物的蒸气压值,但是,这些蒸气压值通常是物质温度为25摄氏度(298 K)或等于其沸点温度时的数值。如果题目中的溶液温度恰好等于其中之一,那么你可以直接使用参考值;但如果不等于,你就需要计算当前温度下的蒸气压。
- 这时可以使用克劳修斯-克拉珀龙方程,将参考蒸气压和298 K (25摄氏度)分别用作P1和T1。
- 本例题中,混合物的温度是25摄氏度,所以我们可以直接使用参考表格。查询表格后可知,25摄氏度时水的蒸气压是23.8 mm HG。

5
计算溶剂的摩尔分数。想要算出答案,最后我们还需要知道溶剂的摩尔分数。摩尔分数的计算非常简单,将组分转换为摩尔,然后计算各种组分占物质总摩尔数的百分比即可。换而言之,各种组分的摩尔分数等于(组分的摩尔数)/(物质的总摩尔数)。
- 假设单糖浆是用1升(L)的水和1升的蔗糖(糖)混合而成。这种情况下,我们需要算出两者的摩尔数。为此,我们要先求出两者的质量,然后使用物质的摩尔质量,将之转换为摩尔数。
- 1升水的质量:1,000克(g)
- 1升原糖的质量:约1,056.7 g
- 水的摩尔数:1,000 g × 1 mol/18.015 g = 55.51 mol
- 蔗糖的摩尔数:1,056.7 g × 1 mol/342.2965 g = 3.08 mol,注意,你可以使用化学式C12H22O11来计算蔗糖的摩尔质量。
- 总摩尔数。55.51 + 3.08 = 58.59 mol
- 水的摩尔分数:55.51/58.59 = 0.947

6
解题。此时,我们已取得解拉乌尔定律方程所需要的一切信息。解题过程非常简单,只需在本节开头的简化拉乌尔定律方程P溶液 = P溶剂X溶剂中代入已知的变量值即可。
- 代入已知值,得到:
- P溶液 = (23.8 mm Hg)(0.947)
- P溶液 = 22.54 mm Hg。答案是合理的,即使在现实世界中,水和糖的体积是一样的,但就摩尔数而言,是少量的糖溶解在大量的水中,所以蒸气压只会略微降低。
方法 3计算特殊情况下的蒸气压

1
注意标准温度和标准压力条件。为了方便起见,科学家常常将一组温度值和压力值当做“默认值”。这些值被称为标准温度和标准压力,或简称为标准状况(STP)。蒸气压问题经常会用到标准状况,所以记住这些值可以方便解题。标准状况的定义是:
- 温度:273.15 K / 0 C / 32 F
- 压力:760 mm Hg / 1 atm / 101.325 kPa

2
将克劳修斯-克拉珀龙方程变形,来求其他变量。在第1节的例题中,我们发现克劳修斯-克拉珀龙方程对于计算纯净物质的蒸气压而言非常实用。但是,并非所有问题都要求计算P1或P2,有些可能会要求计算温度值,有时甚至是ΔHvap值。幸运的是,这种情况下只需将方程变形,让方程等号的一边只剩下待求变量,就能得出正确的答案了。
- 例如,假设一种未知液体在273 K时的蒸气压是25 torr,而在325 K时的蒸气压是150 torr,求这种液体的汽化焓ΔHvap。解题过程如下:
- ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1))
- (ln(P1/P2))/((1/T2) - (1/T1)) = (ΔHvap/R)
- R × (ln(P1/P2))/((1/T2) - (1/T1)) = ΔHvap,这时,代入已知值:
- 8.314 J/(K × Mol) × (-1.79)/(-0.00059) = ΔHvap
- 8.314 J/(K × Mol) × 3,033.90 = ΔHvap = 25,223.83 J/mol

3
计算溶质产生蒸汽时的蒸气压。在上文的拉乌尔定律例题中,溶质糖本身在正常温度下没有产生任何蒸汽。事实也是如此,桌面碗中的糖不会自己蒸发。但是,溶质真的蒸发时,就会影响到蒸气压。 我们需要用到拉乌尔定律方程的修改版本来计算这时的蒸气压:P溶液 = Σ(P组分X组分)。西格玛符号(Σ)意味着我们只需要将不同组分的蒸气压相加,就可以算出答案。
- 例如,假设溶液由苯和甲苯这两种化学物质组成。溶液的总体积是120毫升(mL),苯和甲苯各60 mL。溶液的温度是25 C,此时,苯的蒸气压是95.1 mm Hg,而甲苯的蒸气压是28.4 mm Hg。根据这些值,计算溶液的蒸气压。我们可以使用两种化学物质的标准密度、摩尔质量和蒸气压来算出答案,解题过程如下:
- 苯的质量:60 mL = .060 L × 876.50 kg/1,000 L = 0.053 kg = 53 g
- 甲苯的质量:.060 L × 866.90 kg/1,000 L = 0.052 kg = 52 g
- 苯的摩尔数:53 g × 1 mol/78.11 g = 0.679 mol
- 甲苯的摩尔数:52 g × 1 mol/92.14 g = 0.564 mol
- 总摩尔数:0.679 + 0.564 = 1.243
- 苯的摩尔分数:0.679/1.243 = 0.546
- 甲苯的摩尔分数:0.564/1.243 = 0.454
- 解题:P溶液 = P苯X苯 + P甲苯X甲苯
- P溶液 = (95.1 mm Hg)(0.546) + (28.4 mm Hg)(0.454)
- P溶液 = 51.92 mm Hg + 12.89 mm Hg = 64.81 mm Hg
小提示
- 要使用上述克劳修斯-克拉珀龙方程,温度必须以开尔文(K)为单位进行测量。如果温度是摄氏温度,那么你需要使用如下公式对它进行转换:Tk = 273 + Tc
- 上述方法之所以成立,是因为能量与供给的热量成正比。液体温度是唯一一个能够影响到蒸气压的环境因素。
- 上一篇:如何计算电路的总电阻
- 下一篇:没有了
- 01-23如何拒绝同事的约会邀请
- 02-0211层的房子是洋房吗
- 01-19如何清除树桩
- 01-23如何变得独一无二
- 02-06如何写一首诗表达情感
- 01-23如何许下爱情魔咒
- 01-19如何烹调龙虾尾
- 01-19如何烹饪火鸡肉馅
- 01-19如何点亮南瓜灯
- 01-19如何清除蜡烛油
- 01-18如何集中注意力学习
- 01-16如何有效地学习
- 01-16如何提高学习速度
- 01-16如何成为知识渊博的人
- 01-16如何学习基本英语
